成人慢性疾病,主要包括代谢性疾病、心血管疾病、精神疾病、肿瘤等,严重影响着人类健康。对这些慢性疾病的治疗,过去常用的是对症治疗。例如对糖尿病的治疗,通常是通过胰岛素来控制血糖的增高,缓解糖尿病引起的各种并发症。但如何预防糖尿病的发生一直困扰着科学界和医学界,如何从生命早期找到疾病起源进行早期干预已成全球研究的热点。
近日,浙江大学医学院附属妇产科医院黄荷凤院士与中国科学院分子细胞科学卓越创新中心徐国良院士团队合作,找到了糖尿病的代际传播新机制。他们首次揭示了糖尿病的卵母细胞起源,即母体不良环境可以通过卵母细胞影响子代糖代谢功能,并阐明了其表观遗传调控机理。
北京时间5月18日,这项成果在国际顶级期刊《自然》上在线发表。该成果作为发育源性成人疾病研究的重大突破,为人类认识和防控糖尿病等成年慢性疾病提供了最新的科学视角。教育部生殖遗传重点实验室和浙江大学医学院附属邵逸夫医院陈宾博士、中科院分子细胞科学卓越创新中心杜雅蕊副研究员、复旦大学附属妇产科医院朱虹博士、中科院分子细胞卓越创新中心孙美玲博士和王超博士为共同第一作者。共同通讯作者为黄荷凤院士和徐国良院士。参加这项研究的单位有浙江大学、复旦大学、中国科学院、上海交通大学、中国科学院大学和英国阿尔斯特大学,浙江大学为论文第一单位。

找到代际传播的“钥匙”
黄荷凤院士是一名妇产科医生,在一次次诊疗后,她常常思考母亲对子代会产生什么样的影响?为此,她带领团队致力于开展母体不良环境因素导致的子代成人疾病研究,团队发现高糖/高雄激素等不良因素暴露能够通过改变宫内胚胎/胎儿DNA甲基化谱式,或者通过影响精子/卵子表观修饰而引起慢性疾病的代间/代际遗传。结合临床流行病学调查和动物模型的研究成果,黄荷凤院士认为糖尿病和高血压这些成年的慢性疾病都存在发育起源性,因此率先在国际上提出了“配子源性成人疾病”学说。然而该学说一直未得到有效的证明。为了证实这一假说,黄荷凤团队开始关注以下科学问题:
怀孕之前的母体不良环境是否能影响子代健康?以育龄妇女高发的糖尿病为例,母亲高血糖是否能通过卵母细胞增加子代慢性疾病的风险?这些问题的阐明将有助于丰富和完善这一假说。
为此,研究团队建立了雌性小鼠糖尿病模型。为了排除高血糖对胚胎和胎儿发育的持续影响,研究者巧妙的将受影响的卵母细胞取出进行体外受精和胚胎移植,由健康雌鼠代为孕育和哺育。对子代进行代谢检测,结果显示子代小鼠显现了糖耐量受损。这些结果说明卵母细胞受到高血糖不良环境的影响,增加了后代的成年慢性疾病的易感性,这一发现证实了黄荷凤院士的猜想。
面对这一重大发现,研究团队不禁开始思考到底什么是增加子代糖尿病易感性的“元凶”?浙大团队在对高血糖小鼠的卵母细胞进行转录组分析等一系列复杂实验后,找到了一把关键钥匙——DNA去甲基化酶TET3(TET methylcytosine dioxygenase 3),并提出了卵母细胞TET3不足介导子代慢性疾病发生的调控途径。
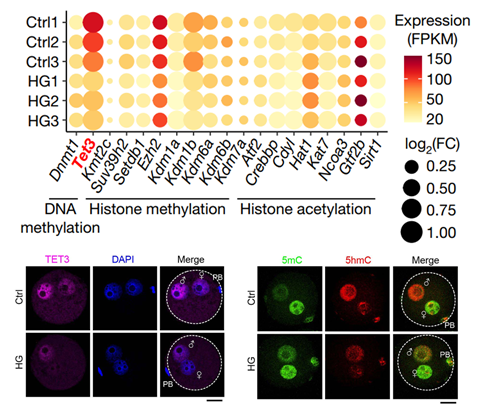
TET3在卵母细胞中表达下降,去甲基化功能受限
浙大团队与徐国良院士课题组展开深入合作,将证实卵母细胞TET3是将不良环境因素传递给后代的关键因素,作为他们面向基础前沿的又一个崭新起点。此前,徐国良院士课题组曾揭示卵母细胞来源的母源因子TET3主要负责对受精卵中父本基因组DNA中胞嘧啶的甲基进行氧化修饰,从而启动DNA去甲基化,这一前期工作为卵源性跨代效应的深入研究提供了方向。
两个团队合作证实,由于糖尿病雌鼠体内的高糖环境,让卵母细胞中具有重编程DNA甲基化谱式功能的TET3蛋白剂量不足,进而使得TET3在受精后进入雄原核中推动重编程的潜能不足,导致“去甲基化不足”或“高甲基化”。“这就好比原来有十个农民耕地(TET3介导氧化去甲基化),现在少了一部分人(TET3不足),很多地就没有开垦完全(DNA甲基化重编程未完全),影响未来的收成(子代健康受到影响)”。
那么TET3又是通过什么样的机制,增加子代糖尿病易感性的呢?调控胰岛素分泌最重要的蛋白之一是葡萄糖激酶GCK。原来,在生命体从一个受精卵细胞开始复制、分裂的过程中,因为受精卵时期TET3不足导致包括葡萄糖激酶Gck在内的一系列胰岛素分泌相关基因高甲基化引发其“潜能开发不足”,这个“潜能不足”的模式一直持续到了子代成年时期。“子代胰岛中Gck等基因的高甲基化和低表达导致了胰岛素分泌不足,降血糖能力的下降,随着年龄的增长,便增加了糖尿病的易感性。”陈宾说。
上医治未病
这个研究在临床上糖尿病助孕妇女中也得到了证实。在杭州、上海多家医院生殖中心收取的临床糖尿病人的未成熟卵母细胞和弃用囊胚也分别显示出TET3表达降低的趋势和GCK启动子区高甲基化的状态,这进一步指明了该研究对于临床的现实意义。
黄荷凤介绍说:该研究成果的创新之处,在于以孕前糖尿病为切入点,对环境作用于卵母细胞诱发子代成年疾病的现象进行了求证,并发现了卵母细胞TET3不足介导子代慢性疾病发生的具体调控机制。有趣的是,在高血糖小鼠的卵子与正常精子受精形成的合子中,其TET3不足介导的雄原核去甲基化不全影响了精子DNA组原有的甲基化重编程模式,包括葡萄糖激酶Gck等一系列胰岛素分泌基因的启动子呈现高甲基化状态。此后,这些高甲基化状态以父本高甲基化的形式持续存在于子代的胰岛上,从而导致胰岛素分泌不足,成年小鼠糖耐量受损,特别是在子代高脂饮食的诱导下更容易诱发糖尿病的发生。
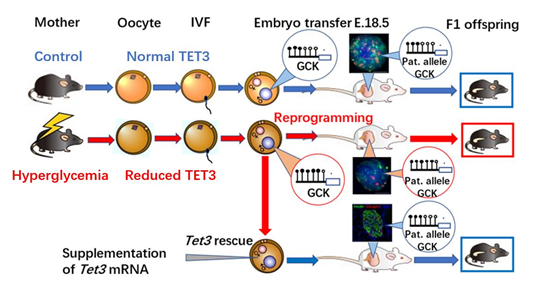
TET3功能不全引起葡萄糖不耐受的母系表观遗传机制示意图
针对这项研究,《自然》同期配发了瑞士弗里德希-米斯科舍生物医学研究所Antoine H. F. M. Peters的评述:“本研究发现了一种通过雌性生殖系传递子代表型的新机制,证实了高血糖使得卵子中TET3双加氧酶的表达异常降低,阻碍了受精后对精子来源DNA的氧化去甲基化过程,进而导致了成年后代的代谢受损。”
美国科学院院士Marisa Bartolomei和美国国家生殖表观基因学研究中心主任Wei Yan教授在《生殖生物学》(Biology of Reproduction)杂志上为该工作撰写亮点评论:“该研究不仅建立了高血糖症通过卵母细胞对子代表观基因组产生不利影响与后代易患代谢紊乱之间的联系,还揭示了潜在的机制。之前,这一假设从未得到验证,更不用说调节的分子机制了。”
中国医学传统中素有“上医治未病”的辩证理念。发育源性成人疾病的研究,揭示了生命早期就可以决定人的健康或者疾病,因此未来对这些疾病的预防要提前到配子发育阶段。“这个研究的结果,为我们对慢病的源头防控提供了变革性思路,从发育源头,配子发生阶段防控慢病,降低出生缺陷、提高我国人口健康水平提供了全新视角和策略。”黄荷凤说,针对糖尿病、高血压常常在家族中聚集发生的现象,未来也要注意生殖环境所致的传代作用,在关心自己本身健康的同时,还有一个意义要保护她(他)的下一代。

黄荷凤院士(右四),徐国良院士(左三),陈宾博士(左四)

